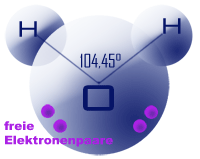
Die kleinste Einheit des Wassers ist das Wassermolekül, eine chemische Verbindung aus zwei Wasserstoffatomen (H) und einem Sauerstoffatom (O), in der Chemie hat es die Formel H2O. So simpel dieser Aufbau auf den ersten Blick erscheinen mag, so liegt die Raffinesse im Detail - wie so oft bei den größten Schöpfungen von Mutter Natur:
Das Molekül ist gewinkelt aufgebaut, die zwei Wasserstoffatome bilden mit dem Sauerstoffatom einen Winkel von exakt 104,45°.
Zudem sind die Atome unterschiedlich elektrisch geladen.
Das Sauerstoffatom selbst besitzt 8 Elektronen. Bei der Molekülbildung mit den 2 Wasserstoffatomen bleiben 4 Elektronen frei, welche sich auf der Gegenseite zu zwei Elektronenpaaren anordnen. Das ganze Molekül ist grundsätzlich neutral, bei den Wasserstoffatomen jedoch tendenziell positiv und bei den Elektronen tendenziell negativ geladen. Dies wird als „elektrischer Dipol“ bezeichnet.
Durch diese asymmetrische Verteilung der positiven und negativen Ladungen im Wassermolekül entstehen die so genannten „Wasserstoffbrücken“, die für zahlreiche chemische und physikalische Anomalien des Wassers wie z.B. die grosse Oberflächenspannung grundlegend sind.
Vor allem vermag Wasser aufgrund seiner Dipolarität auch andere Ionen-Verbindungen aufzuspalten und ist dadurch ein hervorragendes Lösungsmittel für viele Feststoffe, Gase und Flüssigkeiten, die Menschen, Tiere und Pflanzen zum Leben brauchen: z.B. Sauerstoff, Kohlendioxid und Mineralien.
Wasser ist der einzige uns bekannte Stoff, der in der Natur in allen drei Aggregatzuständen existiert:
- flüssig in Form von Regen, Grundwasser oder Oberflächenwasser
- gasförmig als unsichtbarer Wasserdampf in der Luft
- fest als Schnee und Eis
Und auch hier wieder eine der zahlreichen physikalischen Besonderheiten des Wassers, die Lebensräume schafft und erhält: Wasser hat seine größte Dichte mit 1g/ml bei einer Temperatur von 4°C, also in flüssigen Zustand. In diesem Zustand hat es im Verhältnis zu seiner Masse das geringste Volumen.
Gefriert es nun bei 0°C und geht in die feste Phase (Eis) über, ist es gegen alle Gesetzmäßigkeiten leichter als im flüssigen Zustand.
Wäre dies nicht so, würde ein See von unten her zufrieren. Da das Eis aber leichter ist als das flüssige Wasser, schwimmt es an der Oberfläche, während darunter die Lebensräume und ihre Organismen erhalten bleiben.
Wasser – ein Molekül mit perfekten Eigenschaften, die es zur wichtigsten Substanz der Welt machen.